 作者
作者  通讯作者
通讯作者
《分子植物育种》网络版, 2012 年, 第 10 卷, 第 2 篇 doi: 10.5376/mpb.cn.2012.10.0002
收稿日期: 2011年12月31日 接受日期: 2012年01月10日 发表日期: 2012年01月18日
引用格式(中文):
刁卫平等, 2012, 辣椒叶片原生质体分离及愈伤组织形成, 分子植物育种(online) Vol.10 No.2 pp.1012-1016 (doi: 10.5376/mpb. cn.2012.10.0002)
引用格式(英文):
Diao et al., 2012, Protoplast Isolation from Pepper Leaves (Capsicum annuum L.) and Callus Formation, Fenzi Zhiwu Yuzhong (online) (Molecular Plant Breeding) Vol.10 No.2 pp.1012-1016 (doi: 10.5376/mpb.cn.2012.10.0002)
本文以辣椒细胞质雄性不育系21A叶片为试验材料,对原生质体分离过程中的若干因素如酶液组成、酶解时间、低温预处理、纯化时的离心转速及时间进行了比较分析,以探讨辣椒叶片原生质体分离的最佳条件。研究结果表明,辣椒叶片在4℃低温预处理12 h后,经酶液CPW+9%甘露醇+0.1%MSE+0.2%PVP +1.0%纤维素酶+0.5%离析酶+0.2%果胶酶在27℃,转速为50 r/min的摇床上酶解4 h后可获得大量原生质体。纯化时,适当提高离心转速的短时间离心有利于高产量原生质体的获得,以800 r/min离心8 min效果最好。纯化的原生质体稀释后培养在含6-BA的KM8P培养基上,48 h后可见第一次细胞分裂,1个月后可获得愈伤组织。
辣椒(Capsicum spp.)是我国第二大蔬菜作物,作为常异花授粉作物,具有很强的杂种优势。利用细胞质雄性不育(Cytoplasmic male sterility, CMS)系进行辣椒杂交种生产,具有省去人工去雄、降低成本、提高种子纯度和保证种子质量等优点。然而,当前我国辣椒生产上利用CMS进行杂种优势育种中主要存在的问题是缺乏优良的CMS系。由于CMS性状为母性遗传,通过有性杂交再回交的方法转移该性状往往需要6~10年的时间,这无疑限制了辣椒CMS系的选育进程。
原生质体培养为开展体细胞杂交提供了新的途径,通过不同类型的原生质体融合可以在一定程度上克服传统育种方法的不足。而利用原生质体融合技术可以快速实现胞质基因的转移,获得更多基因型的杂种,缩短CMS性状转育时间。自Zelcer于1978年成功地利用原生质体融合实现CMS性状的转移以来,通过该技术转移和改良作物CMS性状已在芸薹属、水稻、番茄、马铃薯、烟草、胡萝卜等作物上成功地应用(蔡小东, 2007)。Yang等(1988)利用经60Co照射的水稻雄性不育系A-58的原生质体与可育系‘Fujiminori’的原生质体电融合后,获得了7个雄性不育水稻新材料;Stephen等(1990)利用原生质体融合技术将油菜‘Polima’胞质雄性不育性成功转移到甘蓝中;Sakai等(1996)通过原生质体融合技术将萝卜恢复系中的一个基因成功转移到油菜不育系中;司家钢等(2002)以胡萝卜雄蕊瓣化型不育材料与可育材料的原生质体为材料电融合后,获得了4个雄性不育株系,并证实为胞质杂种;通过原生质体非对称融合技术,惠志明等(2005)获得了花椰菜与‘Ogura’CMS甘蓝型油菜种间杂种。
与其它茄科植物相比,辣椒原生质体培养研究尚没有取得明显进展,其原因主要在于辣椒原生质体培养和再生难道大,重复性差。目前,国内外仅有少量利用不同辣椒品种的子叶和下胚轴为材料进行原生质体分离、纯化,并获得再生植株的报道(Donato et al.,1989; Jeon et al., 2007; 何晓明等, 1997),而利用辣椒细胞质雄性不育系为材料进行原生质体的研究国内外尚未见报道。本试验利用辣椒细胞质雄性不育系21A无菌苗的叶片分离原生质体,从诸多因素探讨其对原生质体分离产量的影响,并进行培养获得了愈伤组织,为今后通过辣椒原生质体植株再生和融合技术转移细胞质雄性不育性状奠定基础。
1结果与分析
1.1酶液组成和浓度对原生质体产量的影响
在原生质体分离过程中,不同种类的酶、浓度及酶解时间对原生质体产量和活力都有较大影响(表1),在供试的6种酶组合中,随着酶解液浓度的降低,原生质体产量也逐步降低。不同酶组合,达到最大原生质体产量所需的酶解时间不一,总体随酶解液浓度降低所需酶解时间则适当延长。同时,添加果胶酶能明显提高原生质体产量和缩短酶解时间。达到最佳原生质体产量后,如继续延长酶解时间,由于酶解液中原生质体破裂加速,原生质体碎片明显增加,原生质体产量反而相对降低。
.png) 表1 酶液组成和浓度对原生质体产量的影响 注: 同列数据的不同字母表示在5%水平上差异显著 Table 1 Influence of enzymic components and concentrations on the yield of protoplasts Note: Different letters in the same column indicate significant difference at 5% level |
1.2低温预处理对原生质体产量的影响
在最佳酶液条件(EC4)下,对无菌苗在分离制备原生质体前进行低温预处理,其原生质体产量呈显著变化(表2)。原生质体产量呈现先上升后下降的趋势,无菌苗在4℃下处理12 h时产量最高可达为(7.04+0.33 a)×106 cells/g FW,在而处理24 h后原生质体产量最低,仅为(2.56+0.32 d)×106 cells/g FW。处理过程中原生质体产量先上升后下降的原因可能是,处理前期,低温提高了细胞的耐受性,使其在酶解过程中不易破碎,进而提高了原生质体产量。而随着处理时间的延长,辣椒叶片却受到了低温冷害胁迫,导致细胞失水,进而使能分离完整原生质体的细胞明显降低。
|
表2 低温预处理(4℃)对原生质体产量的影响
注: 数据后不同字母表示在5%水平上差异显著 Table 2 Influence of pre-treatment in 4℃ on yield of protoplast Note: Different letters in the same column indicate significant difference at 5% level |
1.3纯化离心对原生质体产量的影响
以细胞质雄性不育系21A的无菌苗叶片为试材,经酶解过滤后,测得原生质体产量为6.42×106 cells/g FW,原生质体纯化时不同离心转速及离心时间对原生质体产量的影响表明(表3),当离心转速较低时(500 r/min),在6~10 min之间,原生质体产量随时间延长而增加,原生质体不易聚集在离心管底部;提高离心转速至800 r/min,在6~10 min之间,原生质体产量随时间延长而减少,但原生质体易在离心管底部聚集,其中以离心8 min的效果最佳;而当离心转速提高至1 000 r/min时,原生质体产量随时间延长明显下降,主要表现为原生质体破裂。
.png) 表3离心转速及离心时间对原生质体产量的影响 注: 数据后不同字母表示在5%水平上差异显著 Table 3 Effects of and time of centrifugation on the yield of protoplasts Note: Different letters in the same column indicate significant difference at 5% level |
1.4 愈伤组织形成
辣椒无菌苗在4℃下预处理12 h,叶片经1%纤维素酶+0.5%离析酶+0.2%果胶酶酶解、过滤和纯化后可产生大量有活力的原生质体(图1A),培养约48 h,发生第一次分裂(图1B)。前3周进行暗培养,每隔1周添加1 mL稀释培养基,3周后将培养物于漫射光下进行培养,当出现肉眼可见的愈伤组织时(图1C),将其转移至扩增培养基弱射光下培养,随后可获得。
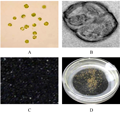 图1辣椒原生质体分离培养及愈伤组织形成 注: A: 纯化的原生质体; B: 第一次细胞分裂; C: 微愈伤组织; D: 愈伤组织 Figure 1 Isolation and culture of protoplasts true leaves of pepper (Capsicum annuum L.) and callus formation. Note: A: Purified protoplast; B: First cell division; C: Micro callus; D: Callus |
2讨论
由于没有细胞壁,原生质体为作物遗传改良和植物学研究提供了极为便利的试验材料。目前,已被广泛应用于种质资源保存(马锋旺和李嘉瑞, 1998; 王子成和邓秀新, 2002)、原生质体融合(司家钢等, 2002; 惠志明等, 2005; 张丽等, 2008)、突变体筛选(Nyman et al., 1993; Wallin et al., 1993)及遗传转化(Jeon et al., 2007; 肖荣凤等, 2009)等基础理论研究。而获得大量有活力的原生质体是原生质体培养成功与否的前提之一,虽然已有很多植物原生质体分离获得成功,但并不是在任何情况下均能获得大量活力好、质量高的原生质体。原生质体分离受到较多因素的影响,包括植物的类型、基因型、外植体类型及生理状态和酶液类型及浓度等。至今,在辣椒上已有利用子叶、下胚轴为起始材料分离原生质体,并获得愈伤组织及再生植株的相关研究报道(Donato et al.,1989; Jeon et al., 2007; 何晓明等, 1997)。本研究利用辣椒叶片为试材,在分离原生质体前对其进行低温预处理,结合酶液组成、离心转速和时间筛选,获得了最佳的辣椒叶片原生质体分离条件,并在此基础上得到了愈伤组织,其研究结果为辣椒原生质体培养再生植株的获得奠定了基础。
此外,原生质体培养是进行原生质体融合的前提。原生质体融合不同于有性杂交,在融合过程中不涉及性配子,在转移胞质基因,培育新的优良细胞质雄性不育系中发挥着重要作用。至今,在很多作物中已利用原生质体融合改良细胞质雄性不育系的报道(Yang et al., 1988; Xue et al., 1995; 蔡小东, 2007)。然而,由于辣椒原生质体培养一直没有取得明显突破,使得还未有利用原生质体融合技术来培育优良不育系的报道。本研究利用辣椒细胞质雄性不育系作为原生质体分离的供体材料,探索出了可以获得大量活力好、质量高辣椒原生质体的分离条件,研究结果也为利用原生质体融合创制辣椒优良胞质不育系奠定了一定的基础。
3 材料和方法
3.1材料
供试材料为辣椒细胞质雄性不育系21A和相应的保持系21B,由江苏省农业科学院蔬菜研究所辣椒课题组提供,于2011年春种植在江苏省农业科学院蔬菜实验基地,常规管理。
3.2无菌苗体系的建立
利用保持系21B的花粉对不育系21A授粉,50 d后采收自然成熟果实。在超净工作台上,用75%酒精对果实表面进行消毒,将果实剖开取成熟种子接种到1/2 MS固体培养基上,分别置于黑暗处及光照下萌芽和生长。培养温度(26±1)℃;光照强度2 000~2 500 Lx,光照时间16 h/d。
3.3原生质体的分离和纯化
取苗龄40 d的无菌苗叶片约1 g,用解剖刀将其切成1 mm宽的细条,置于盛有10 mL酶解液的50 mL离心管中,Parafilm封口,在27℃黑暗条件下放置回旋摇床上酶解(16 g/min)。2% (w/v)纤维素酶,1%果胶酶和1%离析酶分别溶于CPW9 (含9%甘露醇)溶液中配制成基本酶液,Ph 5.8,过滤灭菌,4℃保存。CPW9为(CaCl2﹒2H2O 10 mmol/L,KH2PO4 0.2 mmol/L,KNO3 1.0 mmol/L,MgSO4﹒7H2O 1.0 mmol/L,CuSO4﹒5H2O 0.1 umol/L,KI 10 umol/L),添加0.1% MES,0.2% PVP。用时,根据需要添加不同比例的酶母液配制成各种浓度的工作液(表1)。
将酶解后的混合物用300目无菌尼龙网过滤,将滤液在50 mL离心管中离心,去上清液,用CPW9溶液悬浮底部沉淀的原生质体,洗涤离心2次。再用原生质体培养液悬浮离心1次,然后在显微镜下检查其纯化情况,并稀释成密度约105个/mL原生质体悬浮液备用。原生质体产量测定参照李浚明(1992)的方法,重复3次。
3.4原生质体的培养及愈伤组织形成
将纯化好活性高的原生质体悬浮于添加含有6-BA的KM8P培养基上,在(26±1)℃黑暗条件下采用液体浅层培养法进行培养。把3 mL悬浮于培养基的原生质体滴加到直径60mm的培养皿中,Parafilm封口,在28℃黑暗条件下培养,2周后,添加无甘露醇的含有6-BA的KM8P液体培养基于培养皿中,以稀释再生细胞团的密度和降低甘露醇浓度。
作者贡献
刁卫平是本研究的实验设计和实验研究的执行人;王述彬是项目的构思者,指导实验设计,论文修改;刘金兵和潘宝贵参与试验结果分析;戈伟提供试验材料。全体作者都阅读并同意最终的文本。
致谢
本研究由国家大宗蔬菜产业技术体系淮安综合试验站项目(CARS-25-G-14)、江苏省自然科学基金项目(BK2010464)和江苏省农业科技自主创新基金项目(CX(10)103; CX(11)1004)给予本试验的经费支持。
参考文献
Cai X.D., 2007, The advance of transfer CMS trait using protoplast fusions in crop, Changjian Daxue Xuebao (Journal of Yangtze University (Nat Sci Edit) Agri Sci V), 4(4): 86-90 (蔡小东, 2007, 利用原生质体融合技术转移作物CMS性状的研究进展, 长江大学学报(自科版)农学卷, 4(4): 86-90)
Donato M.D., Perucco E., and Mozzetti C., 1989, Protoplasts culture and callus proliferation from cotyledons of Capsicum annuum L., Adv Hortic Sci, 3: 17-20
He X.M., Wang M., and Wang Z., 1997, Protoplast culture and plant regeneration from cotyledons of pepper, Yuanyi Xuebao (Acta Horticulturae Sinica), 24(3): 298-300 (何晓明, 王鸣, 王之, 1997, 辣椒子叶原生质体培养和植株再生, 园艺学报, 24(3): 298-300)
Hui Z.M., Liu F., Jian Y.C., Shen S.X., and Zhao H., 2005, Interspecific somatic hybrids between Brassica oleracea var. botrytis and Ogura type CMS Brassica napus via asymmetric protoplast fusion, Zhongguo Nongye Kexue (Scientia Agricultura Sinica), 38(11): 2372 (惠志明, 刘凡, 简元才, 申书兴, 赵泓, 2005, 原生质体非对称融合法获得花椰菜与ogura CMS甘蓝型油菜种间杂种, 中国农业科学, 38(11): 2372)
Jeon J.M., Ahn N.Y., Son B.H., and Kim C.Y., 2007, Efficient transient expression and transformation of PEG-mediated gene uptake into mesophyll protoplasts of pepper (Capsicum annumm L.), Plant Cell Tiss Organ Cult, 88: 225-232
http://dx.doi.org/10.1007/s11240-006-9194-z
Li J.M., ed., 1992, Plant tissue culture course, Beijing Agricultural University Press, Beijing, China, pp.274-275 (李浚明, 主编, 1992, 植物组织培养教程, 北京农业大学出版社, 中国, 北京, pp.274-27)
Ma F.W., and Li J.R., 1998, Cryopreservation of apricot protoplasts, Yuanyi Xuebao (Acta Horticulturae Sinica), 25(4): 329-332 (马锋旺, 李嘉瑞, 1998, 杏原生质体的超低温保存, 园艺学报, 25(4): 329-332)
Nyman M., and Wallin. A., 1993, Somaclonal variation in protoplast derived strawberry plants, Acta Hort, 348: 441
Sakai T., Liu H J., Iwabuchi M., Kohno-Murase J., and Imamura J., 1996, Introduction of a gene from fertility restored radish into Brassica napus by fusion of X-irradiated protoplasts from a radish restorer line and iodacetoamide-treated protoplasts from a cytoplasmic male-sterile cybrid of B.napus, Theor. Appl. Genet., 93: 373-379
http://dx.doi.org/10.1007/BF00223179
Si J.G., Zhu D.W., Du Y.C., and Zhao Z.Z., 2002, Intraspecific cybrids in carrot (Daucus carata L.) obtained from asymmetric protoplast fusion, Yuanyi Xuebao (Acta Horticulturae Sinica), 29(2): 128-132 (司家钢, 朱德蔚, 杜永臣, 赵志伟, 2002, 原生质体非对称融合获得胡萝卜种内胞质杂种, 园艺学报, 29(2): 128-132)
Stephen A.Y., Laurie A.B., Richard P.W., and Roger J.K., 1990, The transfer of ‘Polima’ cytoplasmic male sterility from oilseed rape (Brassica napus) to broccoli (B. oleracea) by protoplast fusion, Plant Cell Reports, 9: 185-188
Wang Z.C., and Deng X.X., 2002, Cryopreservation of citrus protoplasts, He’nan Daxue Xuebao (Journal of Henan University (Natural Science)), 32(3): 38-40 (王子成, 邓秀新, 2002, 柑橘原生质体的超低温保存, 河南大学学报, 32(3): 38-40)
Wallin A., Skjoldebrand H., and Nyman M., 1993, Protoplasts as tools in Fragaria breeding, Acta Hort, 348: 414-421
Xiao R.F., Zhu Y.J., Li Y.D., Huang S.F., and Liu B., 2009, Green fluorescent ptotein gene transformation on Fusarium oxysporum f.sp.niveum strain, FOV-135, Fujian Nongye Xuebao (Fujian Journal of Agricultural Sciences), 24(6): 521-524 (肖荣凤, 朱育菁, 李燕丹, 黄素芳, 刘波, 2009, 西瓜尖孢镰刀菌FOV-135的绿色荧光蛋白基因转化, 福建农业学报, 24(6): 521-524)
Xue Q.Z., and Earle E.D., 1995, Plant regeneration from protoplasts of cytoplasmic male sterile lines of rice (Oryza sativa L.), Plant Cell Reports, 15: 76-81
http://dx.doi.org/10.1007/BF01690258
Yang Z.Q., Shikanai T., and Yamada Y., 1988, Asymmetric hybridization between cytoplasmic male-sterile (CMS) and fertile rice (Oryza sativa L.) protoplasts, Theor. Appl. Genet., 76: 801-808
http://dx.doi.org/10.1007/BF00273664
Zhang L., Zhao H., Chen B., and Liu F., 2008, Development and identification of interspecific somatic hybrids between cauliflower and black mustard, Zhiwuxue Tongbao (Chinese Bulletin of Botany), 25(2): 176-184 (张丽, 赵泓, 陈斌, 刘凡, 2008, 花椰菜与黑芥种间体细胞杂种的获得和鉴定, 植物学通报, 25(2): 176-184)